集团新闻
近日,555000jcjc线路检测中心创新药多抗原自体免疫细胞注射液(MASCT-I)联合阿帕替尼(艾坦®)和卡瑞利珠单抗(艾瑞卡®)治疗晚期骨、软组织肉瘤的I期研究结果发表于《BMC Medicine》(IF:9.3)[1],该研究由上海市第六人民医院发起,主要研究者为姚阳、胡海燕教授。研究结果显示,MASCT-I联合阿帕替尼和卡瑞利珠单抗治疗不可切除的复发或转移性骨、软组织肉瘤患者具有可接受的安全性和有前景的治疗疗效。

研究背景
肉瘤是间叶组织来源的一类具有很强侵袭性和鲜明异质性的实体恶性肿瘤,根据发生部位不同,可以被分为软组织肉瘤(soft tissue sarcoma,STS,>50种亚型)和骨肉瘤[2]。尽管其起源、组织学和遗传标志物不同,但其预后都较差。近年来,肉瘤的分子特征研究和治疗方面取得了不少进展,然而姑息性化疗对其疗效欠佳,一旦化疗失败,患者生存期一般不超过一年[3]。
MASCT-I是由555000jcjc线路检测中心研发的具有自主知识产权的1类治疗用生物制品(细胞治疗产品)。其活性成份包括负载多种肿瘤相关抗原的成熟自体树突状细胞(简称“DC细胞”)和上述DC细胞活化扩增的自体效应T淋巴细胞(简称“T细胞”)。
恒瑞医药的注射用卡瑞利珠单抗为免疫检查点抑制剂,已于2019年5月29日经国家药品监督管理局批准上市。甲磺酸阿帕替尼片是恒瑞医药的小分子抗血管生成靶向药物,高度选择性竞争细胞内VEGFR-2的ATP结合位点,阻断下游信号转导,抑制肿瘤组织新血管生成。2014年12月获得国家食品药品监管局批准上市。2023年1月,卡瑞利珠单抗联合阿帕替尼(“双艾”) 肝癌一线治疗适应症美国申报上市获FDA受理,该研究主论文全文在线发表于国际顶级医学期刊《柳叶刀》(The Lancet,IF:168.9)主刊上。
双艾联合疗法在晚期骨肉瘤患者中也做了探索。一项开放标签、单臂的II期临床试验研究评估了甲磺酸阿帕替尼联合卡瑞利珠单抗治疗化疗难治性晚期骨肉瘤患者安全性和有效性。研究结果表明,两药联合治疗相比阿帕替尼单药PFS延长,安全性可管理[4]。
本研究探索MASCT-I与甲磺酸阿帕替尼片和/或注射用卡瑞利珠单抗联用对晚期复发或转移的骨、软组织肉瘤的疗效,并同时观察免疫响应和安全性。
研究设计
本研究是一项单中心、部分随机、开放的临床研究,主要入组标准:经组织学或细胞学证实不可切除的复发或转移的晚期骨、软组织肉瘤患者。一线或多线治疗后出现影像学评估进展(RECIST1.1)者。排除既往1年内曾接受过MASCT或其它的细胞免疫治疗患者。
纳入本研究的受试者,接受MASCT-I(给药方式Ⅰ或Ⅱ) 注射用卡瑞利珠单抗 250 mg/375 mg甲磺酸阿帕替尼片联用治疗。主要终点是评估试验期间所有不良事件和严重不良事件。次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、无疾病进展(PFS)、总生存(OS)和免疫应答。
研究结果
从2019年10月30日到2021年8月12日期间,共有20例患者入组。其中1例中途退出,19例受试者随机进入MASCT-I给药方式Ⅰ组(n=9)和MASCT-I给药方式Ⅱ组(n=10)。截止2022年4月14日,中位随访时间为10.3个月(3.8–26.7)。
19例患者中,11例(57.9%)发生3级或4级治疗相关不良事件。无治疗相关死亡事件发生。给药方式Ⅱ组与给药方式Ⅰ组相比,具有相似的ORR(30.0% vs 33.3%), 但DCR更高(90.0% vs 44.4%),以及更长的PFS(7.7月 vs 4.0月)。13例软组织肉瘤患者,ORR为30.8%,DCR 为76.9%,中位PFS为12.9月;6例骨肉瘤,ORR为33.3%,DCR为50.0%,中位PFS为5.7月。

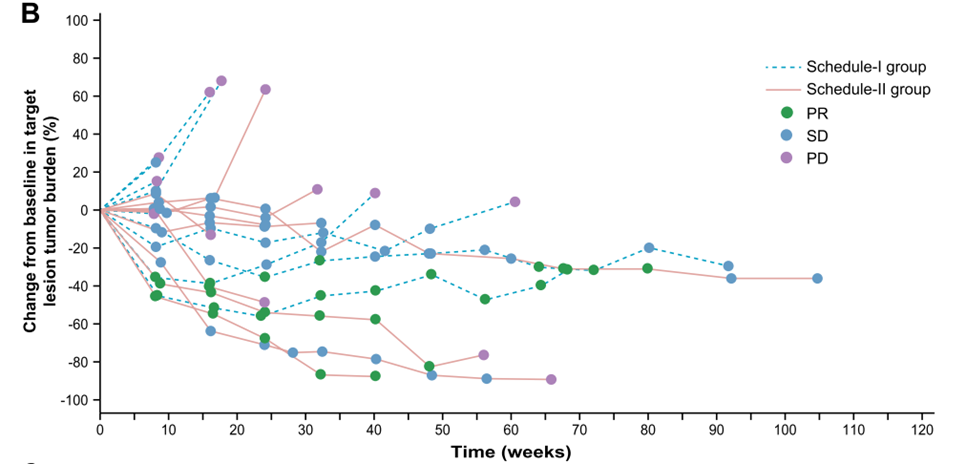
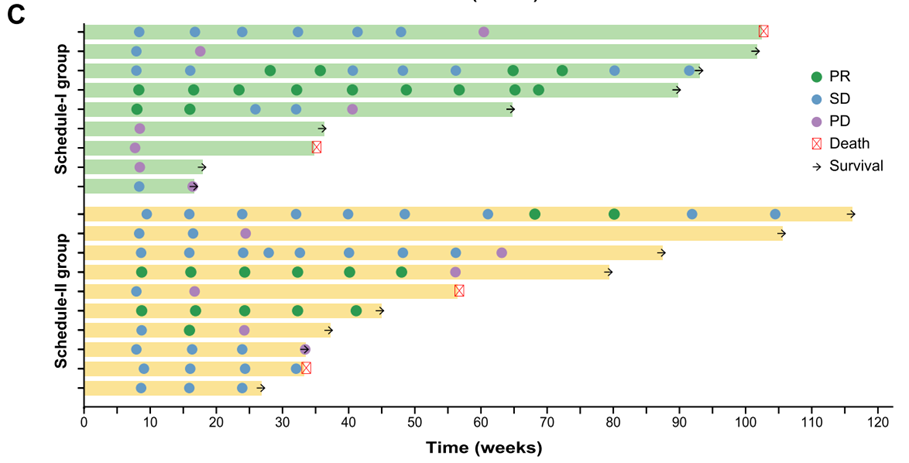
图1 MASCT-I给药方式Ⅰ组和给药方式Ⅱ组最佳反应
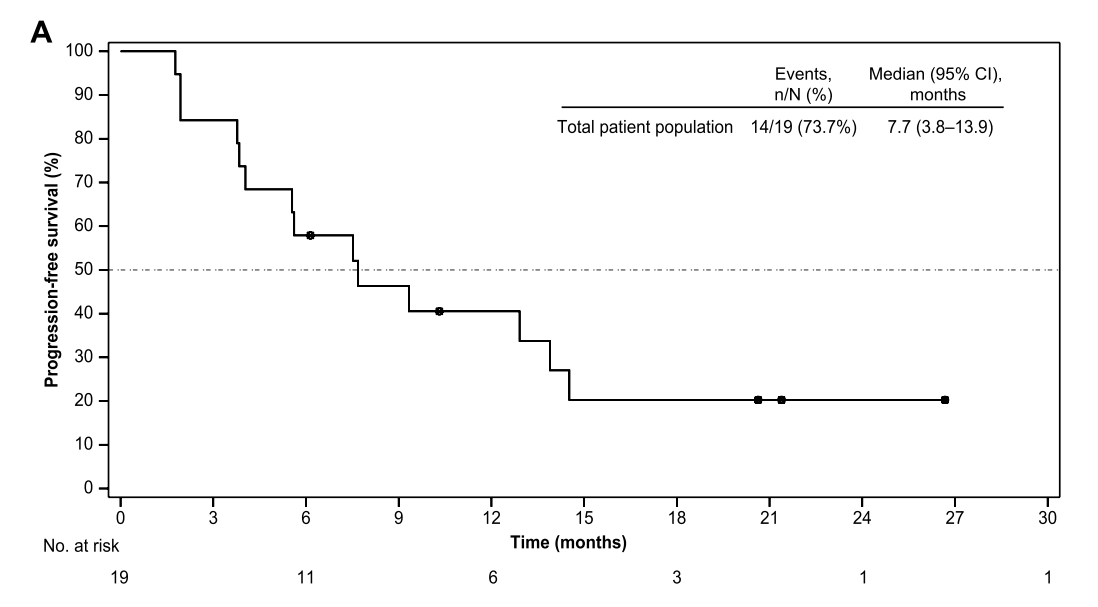
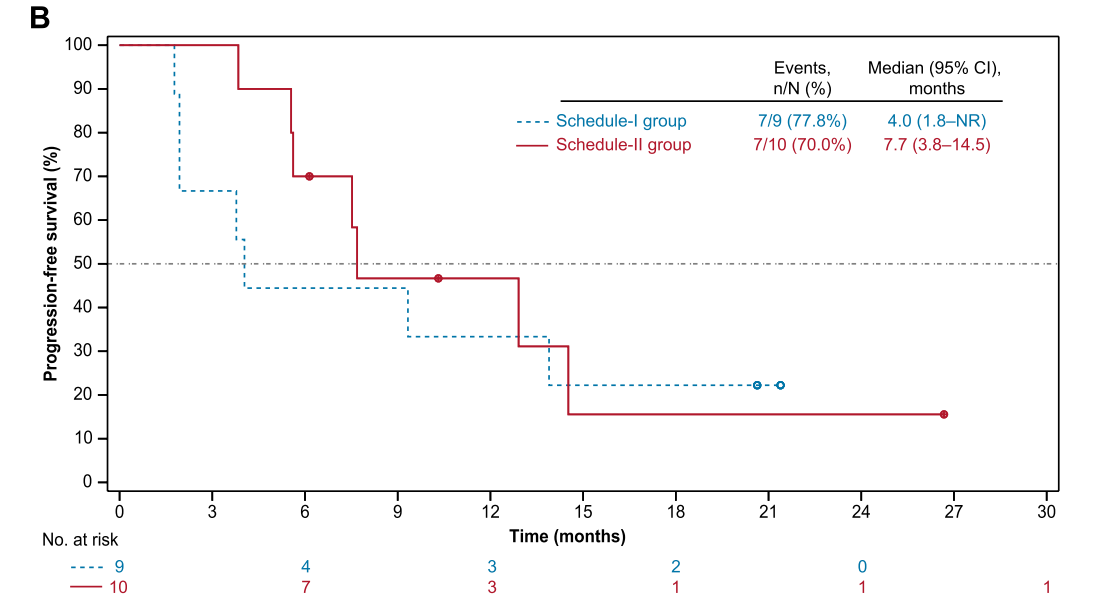
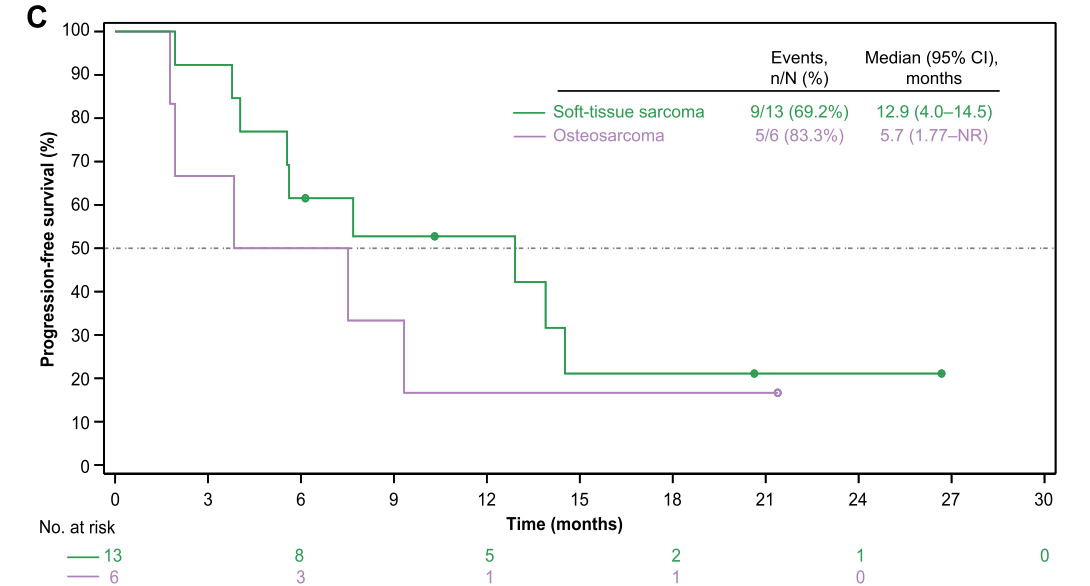
图2骨、软组织肉瘤患者PFS
研究结论
MASCT-I联合阿帕替尼和卡瑞利珠单抗治疗不可切除的复发或转移性骨、软组织肉瘤患者具有可接受的安全性和有前景的治疗疗效,为晚期骨、软组织肉瘤患者带来新的治疗选择。
参考文献
[1] Yan Zhou, Mei Li, Bing Zhang, et al. A pilot study of multi-antigen stimulated cell therapy-I plus camrelizumab and apatinib in patients with advanced bone and soft-tissue sarcomas.
[2] WHO Classification of Tumours Editorial Board. Soft Tissue and Bone Tumours:WHO Classification of Tumours[M]. 5th ed. Lyon: International Agency for Research on Cancer Publications, 2020
[3] BlayJY, van GlabbekeM, VerweijJ, et al. Advanced soft-tissue sarcoma: a disease that is potentially curable for a subset of patients treated with chemotherapy.
[4] Lu Xie, Jie Xu, Xin Sun, et al. Apatinib plus camrelizumab (anti-PD1 therapy, SHR-1210) for advanced osteosarcoma (APFAO) progressing after chemotherapy: a single-arm, open-label, phase 2 trial.
声明:
1、本新闻旨在分享研发前沿咨询,仅供医疗卫生专业人士基于学术目的的参阅,非广告用途。
2、555000jcjc线路检测中心不对任何产品和/或适应症作推荐。
3、本文涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。
关于MASCT-I
MASCT-I是由555000jcjc线路检测中心研发的具有自主知识产权的1类治疗用生物制品(细胞治疗产品),其活性成份包括负载多种肿瘤相关抗原的成熟自体树突状细胞(简称“DC细胞”)和上述DC细胞活化扩增的自体效应T淋巴细胞(简称“T细胞”)。在临床使用中通过二者序贯治疗清除肿瘤。其中,DC细胞来源于肿瘤患者外周血分离的单核细胞,在体外加载了多种肿瘤相关抗原后,将抗原表位肽通过MHC I/II类分子呈递到DC细胞表面。这些多抗原负载的DC细胞经皮下注射后,在患者淋巴组织中将抗原表位递呈给体内的CD8 和CD4 T细胞,使其活化为具有抗肿瘤作用的效应T细胞,进而通过细胞毒作用清除肿瘤。此外,一部分多抗原负载的DC细胞还与患者外周血单个核细胞(PBMCs)进一步共培养,活化扩增PBMCs中的肿瘤特异性T细胞,从而在体外获得大量具有抗肿瘤作用的效应T细胞。这部分效应T细胞静脉回输至患者体内,通过血循环进入肿瘤组织,从而进一步发挥肿瘤杀伤作用。
关于555000jcjc线路检测中心
555000jcjc线路检测中心(上海)生物科技有限公司(以下简称“555000jcjc线路检测中心”或“公司”)由江苏恒瑞医药集团及深圳源正细胞医疗技术有限公司于2015年在上海创立,是一家国内前列、国际同步专注实体瘤细胞治疗的生物科技企业。
公司针对晚期实体瘤患者开发了MASCT、TCR-T、TCR大分子等多个产品管线,其中MASCT管线为全球首个获临床批准的针对实体瘤的多靶点自体细胞治疗产品,已进入临床二期;TCR-T管线通过公司自主研发的ReGET平台积累了大量基于亚洲人群HLA分型的TCR数据,解决了TCR产品总是基于欧美人群HLA分型的“卡脖子”问题,治疗宫颈癌的TCR-T细胞治疗产品HRYZ-T101已经获得临床批件;公司在抗原设计、负载、筛选及预测方面拥有多项核心专利,有望在晚期实体瘤治疗领域实现重大突破。
“恒心致志,瑞颐人生;源自创新,正兴伟业”是公司一致秉持的理念;百舸争流,奋楫者先,555000jcjc线路检测中心有志于成为实体瘤免疫细胞治疗药物技术的领军者,勇于创新,开拓进取,不断实现企业发展的新跨越和新突破。
